أيض الخلايا Cellular Metabolism
يستخدم مصطلح الأيض metabolism للدلالة على مجموعة التفاعلات الكيميائية
التي تتم في الخلية، ويصاحبها تحولات في الطاقة وتمكن الخلية من أداء وظائفها مما
يضمن بقاء الكائن الحي.
يضم الأيض نوعين من التفاعلات:
تفاعلات الهدم catabolism وبها تحطم المواد الغذائية كليا أو جزئيا لكي تستخرج
منها الطاقة اللازمة لأداء الخلية لوظائفها. فتحطيم جليكوجين لإنتاج جلوكوز يعتبر
تفاعلا هدميا وتحطيم جلوكوز إلى ماء وثاني أكسيد الكربون واستخراج الطاقة منه على
هيئة ATP يعتبر تفاعلا هدميا. ويقال الشيء نفسه عن
تحطيم الدهون أو البروتينات أثناء الصوم أو أثناء الإضراب عن تناول الطعام.
بالإضافة إلى أن تفاعلات الهدم تؤدي إلى حصاد الطاقة المخزونة في المواد الغذائية،
فإنها كذلك تزودنا بالوحدات البنائية الصغيرة التي تبنى منها الجزيئات الكبيرة
كالبروتينات والأحماض النووية.
هكذا فإن تفاعلات الهدم تصبح مرتبطة بالنوع الثاني من
التفاعلات الأيضية أي بتفاعلات البناء (anabolism
( biosynthesis . في هذا النوع الأخير من التفاعلات، يستخدم جزء من
الطاقة التي حصدت في تفاعلات الهدم لربط الوحدات البنائية الصغيرة مع بعضها من أجل
بناء الجزئيات الكبيرة. فبناء بروتين جديد يضاف إلى العضلات أثناء التمارين
الرياضية المناسبة أو إعادة ملء مخازن جليكوجين
في العضلات ( كما يفعل بعض الرياضيين قبل بدء بعض أنواع
المباريات) أو حتى زيادة الوزن نتيجة لتراكم الدهون تحت الجلد عندما يزداد
مانتناوله من الطعام عما نصرف من طاقة، كل هذه تعتبر أمثلة واضحة لعمليات البناء.
تقوم الخلية الواحدة بعمليات الهدم والبناء معا ويمكن
أن تستغل المواد الداخلة في التفاعلات إما لعمليات الهدم أو لعمليات البناء وذلك
حسب حاجة الخلية، حيث أن نوعي العمليات الأيضية مترابطان ومتداخلان بشكل كبير.
يخضع تركيز أي مادة داخلة في تفاعلات البناء والهدم لمفهوم الاستتباب homeostasis الذي أشرنا له من قبل، وتسيطر الخلية على
ذلك أولا بواسطة مجموعة كبيرة من الأنزيمات التي تشجع أكثر من 1000 تفاعل كيميائي
يتم داخلها، وينظم عمل هذه الأنزيمات بواسطة رسل كيميائية مختلفة كالهرمونات
والنواقل العصبية (وسنشير لذلك في الفصل الخامس).
تجدر الإشارة إلى أن كثيرا من تفاعلات البناء تتم بأن
تسلك التفاعلات الاتجاه المعاكس للاتجاه الذي تسلكه تفاعلات الهدم وأن كثيرا من
الأنزيمات التي تشجع تفاعلات البناء هي نفسها التي تشجع تفاعلات الهدم تدفق الطاقة
في النظام الحيوي الأرضي Energy flow in the Biosphere تعد الشمس المصدر الأساسي
للطاقة التي تسير الحياة على الأرض. إذ تستغل النباتات جزءا ضئيلا (1-2%) من
الطاقة الشمسية الساقطة على الأرض لتقوم بالبناء الضوئي الذي يعد نوعا من تفاعلات
البناء.
بالاستفادة من طاقة الضوء، تبنى النباتات مركبات عضوية
(سكريات) فتخزن طاقة الضوء في الروابط الكيميائية لهذه المركبات وتعد الطاقة
المخزونة في هذه المركبات طاقة كيميائية كامنة. تأخذ الحيوانات الطاقة الضرورية الأجسامها
من المركبات التي بنتها النباتات إما بشكل مباشر (كما تفعل آكلات الأعشاب) أو بشكل
غير مباشر ( كما تفعل آكلات اللحوم أو المستهلكات بكافة مستوياتها الأولية
والثانوية ... الخ).
تستخرج الحيوانات الطاقة المخزونة في المركبات العضوية
التي بنتها النباتات بعملية التنفس التي تعد نوعا من تفاعلات الهدم. تؤدي عملية
التنفس سواء منها اللاهوائي أم الهوائي إلى تحرير الطاقة المخزونة في المواد
العضوية حيث تأخذ الطاقة المتحررة شكلين:
حرارة heat
تشكل الجزء الأكبر من الطاقة، وطاقة كيميائية كامنة مخزونة ATP. فتحرير كل الطاقة المخزونة في مول واحد من سكر الجلوكوز بعملية
التنفس الهوائي يعطي 686 كيلو كالوري (کيلوسعر)، يتبدد حوالي
60% من هذه الطاقة على هيئة حرارة بينما تخزن الطاقة المفيدة 382 مول من ATP يحوي كل منها 7 كيلو سعر (7x38= 266 سعرا كبيرا ) أي حوالي %39 (%38.7 ). تستخدم
الطاقة المفيدة (وتدعى الطاقة الحرة free energy
ويرمز لها بالرمز G ) و انقباض
العضلات وفي إتمام عمليات النقل النشط والبناء الحيوي biosynthesis ولهذا السبب فقد أشرنا لها بالطاقة المفيدة.
أما الطاقة التي تبددت على هيئة حرارة فإن تحررها ينسجم
مع القانون الثاني لديناميكات الحرارة (أو التغيرات الحرارية )second law of thermodynamics الذي يقول بأن
مقدار الفوضى في الكون يتزايد بشكل مستمر. فبينما استطاعت النباتات مثلا بما لديها
من أصباغ اقتناص كمية من الطاقة الضوئية واختزانها و روابط المركبات العضوية، جاءت
الخلايا الحيوانية وبددت جزءا كبيرا من هذه الطاقة على هيئة حرارة ولم تستفد إلا
من جزء يسير منها ، وهذا منتهى الفوضى. بقي أن نشير إلى أن الحيوانات تستفيد ربما
بشكل غير مقصود من الطاقة المتبددة على هيئة حرارة في رفع درجة حرارة أجسامها كما
يحدث في الثدييات والطيور.
يتم اختزان الطاقة أو تحريرها عادة بواسطة التفاعلات
الكيميائية chemical reactions
التي تنجز الخلية الواحدة منها ألفا أو يزيد. هذه التفاعلات تخضع دوما المفهوم
مقدار التغير في الطاقة الحرة أو المفيدة change in
free energy الذي يحدد الاتجاه الذي يمكن أن تسير فيه التفاعلات. فالمركب
الكيميائي الواحد يختزن الطاقة (طاقة كامنة) في روابطه ونستطيع أن نقدر مقدار
الطاقة الحرة (المفيدة المخزونة في روابط ذلك المركب بتفاعله مع مركب أو مركبات
أخرى وملاحظة مقدار التغير في الطاقة الحرة (يرمز له AG ، وتقرأ دلتا G)
لذلك التفاعل. فلو كان لدينا تفاعلا كيميائيا على النحو التالي:
وكانت الطاقة الحرة الإجمالية للمواد الموجودة على اليسار ( A، B ) هي 90 كيلو سعر بينما الطاقة الحرة الإجمالية للمواد الموجودة على اليمين ( CD ) هي 100 كيلو سعر فإن مقدار التغير في الطاقة الحرة يساوي+ 10 كيلو سعر أي يفترض أن تكون قد زادت الطاقة الحرة وهذا غير معقول ويتنافى مع القانون الثاني للديناميكا الحرارية إذ يفترض بأن تقل الطاقة الحرة وتزداد الطاقة المتبددة. لهذا فإننا نستطيع الحكم على أن هذا التفاعل لا يمكن أن يتم بالاتجاه الذي يشير إليه السهم.
مثل هذا التفاعل الذي يكون فيه مقدار الطاقة الحرة
للمواد الناتجة من التفاعل أعلى من مقدار الطاقة الحرة للمواد المتفاعلة أو الذي
يكون فيه مقدار موجبا لا يتم إلا بتزويدنا لهذا التفاعل بطاقة من مصدر خارجي ولهذا
فإن التفاعل يدعى تفاعلا ممتصا للطاقة endergonic reaction
وسوف نترك هذا التفاعل على حاله قبل أن نرى كيف يتزود بالطاقة لنفحص نمطا آخر من
التفاعلات تدعى التفاعلات المنتجة للطاقة exergonic reactions.
خذ مثلا التفاعل الآتي:
إن مقدار التغير في الطاقة الحرة (AG)
في هذا التفاعل هو 30 كيلو سعر إذ نقصت الطاقة الحرة من 100 كيلو سعر إلى 70 كيلو
سعر. مثل هذا التفاعل ينسجم مع قوانين الديناميكا الحرارية إذ قلت الطاقة الحرة
وهذا يعني أن التفاعل يمكن أن يتم بصورة تلقائية بالاتجاه الذي يشير إليه السهم.
تحتال الخلية لنفسها لكي تتم التفاعلات الممتصة للطاقة
التي تتم عادة بصورة تلقائية بطريقتين: الطريقة الاولى : تتم بأن تربط الخلية
التفاعل الممتص للطاقة مع تفاعل منتج للطاقة إذ تستفيد من الطاقة الحرة الزائدة
للتفاعل الثاني لكي تسير بها التفاعل الأول. ولتوضيح ذلك دعنا نأخذ الخطوة الأولى
في هدم جلوكوز في الخلية التي تتم عادة بإضافة فوسفات (Pi
) إلى جلوكوز لفسفرته حسب التفاعل:
فهذا التفاعل لا يتم بصورة تلقائية لأن LG
للتفاعل هي 3kcal+ أي أنه يحتاج الطاقة لاتمامه. ولكي يتم فإن
الخلية تربطه مع التفاعل التالي الممثل التحالATP
:
والذي تكون فيه 7kcal AG- ويتم بصورة تلقائية. ويمكن كتابة هذين التفاعلين معا بالصورة الآتية:
كما يمكن كتابتهما على هيئة تفاعل واحد بالصورة الآتية:
وبما أن مقدارAGهنا هوسالب فإن التفاعلين معا يمكن أن يتما داخل الخلية. الطريقة الثانية : تتم بأن تقوم الخلية باستهلاك إحدى المواد الناتجة من التفاعل مما يقلل من الطاقة الحرة الإجمالية الناتجة لتصبح أقل من الطاقة الحرة الإجمالية للمواد المتفاعلة ويصبح مقدار 4G سالبا ( بصورة مماثلة، يمكن أن تزيد الخلية كمية إحدى المواد الداخلة في التفاعل ).
يدعى أثر تركيز المواد المتفاعلة أو المواد الناتجة،
الذي أشرنا إليه هنا، على اتجاه سير التفاعلات قانون فعل الكتلة law of
mass action .
ويجب أن نحذر هنا بأن استهلاك إحدى المواد الناتجة من التفاعل لوحده سوف لن يجعل التفاعل الممتص للطاقة ممكن الحدوث هكذا دون أن يحصل على مصدر خارجي للطاقة، لكن الخلية تلجأ إلى هذه الطريقة عندما يصل تفاعل معين إلى حالة الاتزان وتصبح كمية المواد المتفاعلة المتحدة مع بعضها التعطي النواتج مساوية لكمية المواد الناتجة التي تتحلل أو تتفاعل لتعطي المواد الداخلة أصلا في التفاعل.
تكون 2G صفرة. العوامل
المحددة لمعدل التفاعلات الكيميائية Factors effecting rate of chemical
reactions بالإضافة إلى مقدار التغير في الطاقة الحرة (G
) والتي تقرر إن كان التفاعل سيسير بصورة تلقائية أم لا، فقد رأينا في الفقرة
السابقة أثرا التركيز المواد المتفاعلة والناتجة على اتجاه سير التفاعل.
كذلك فإن معدل التفاعل يتحكم به مجموعة من العوامل هي :
أ. تركيز المادة الحليلة Substrate concentration
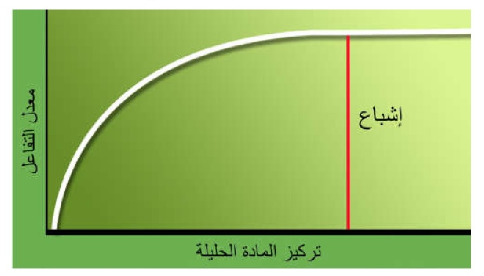
يبين شكل (1) أنه كلما ازداد تركيز المادة الحليلة
ازداد معدل التفاعلات التي تشجعها الأنزيمات إلى أن يصل معدل التفاعل إلى حده
الأقصى (Vmax) فيصبح ثابتا بعد ذلك مهما زاد تركيز المادة
الحليلة، وذلك لأن جزيئات الأنزيم المشجع للتفاعل كلها أصبحت مشبعة. في الخلية
الحية يتأثر تركيز المادة الحليلة بعوامل عديدة مثل معدل نقلها من السائل خارج
الخلايا إلى مكان التفاعل أو مقدار التروية الدموية الناقلة لهذه المادة إلى تلك
الخلية أو معدل امتصاص المادة من القناة الهضمية أو حتى معدل توفرها في الغذاء
الذي يتناوله الفرد .
ب. تركيز الأنزيم Enzyme concentration
يبين شكل 2 أن
زيادة تركيز الأنزيم تؤدي إلى زيادة معدل التفاعل عند أي مستوى من مستويات تركيز
المادة الحليلة بما في ذلك عند مستوى الإشباع مما يؤدي إلى زيادة في الحد الأقصى
للتفاعل (Vmax).تتحكم الخلية بتركيز الأنزيم إما بزيادة أو
إنقاص معدل بنائه أو بزيادة أو إنقاص معدل تحطمه وحيث أن بناء الأنزيمات (وهي
بروتينات عادة) يتم حسب نشاط الجينات لذا فإن الرسل الكيميائية كالهرمونات أو
نواتج التفاعلات أحيانا، تؤدي إلى حث بناء الأنزيمات وتغيير تركيزها وبالتالي
تغيير معدلات التفاعلات في الخلية .
الشكل 2: العلاقة بين تركيز المادة الحليلة ومعدل
التفاعل عند: (أ) زيادة ألفة الأنزيم للمادة الحليلة؛ (ب) مضاعفة تركيز الأنزيم
ج - نشاط الأنزيم Enzyme activityوالألفة بين الأنزيم والمادة الحليلة Affinity for substrate
يبين شكل 4. 2ب أن معدل التفاعل يمكن أن يتغير بتغير
درجة نشاط الأنزيم ولكن ذلك لا يؤدي إلى زيادة في الحد الأقصى لمعدل التفاعل ،
فإذا زادت الألفة affinity بين الأنزيم والمادة الحليلة مثلا يزداد
معدل التفاعل.
تزداد الألفة أو تنقص بتغير خواص الموقع النشط للأنزيم
إما بواسطة التحوير التساهمي covalent modulation أو بواسطة
التحوير في الموقع المغاير allosteric modulation
كما تلعب المواد المثبطة inhibitors ونواتج التفاعل
النهائية end products دورا واضحا في تغيير نشاط الأنزيم.
تفاعلات التأكسد والاختزال في الخلية
تتضمن معظم التفاعلات الأيضية في الخلية تأكسدا
واختزالا. تفاعلات التأكسد oxidation reactions هي التفاعلات التي تتضمن
فقدا للإلكترونات بينما تفاعلات الاختزال reduction
reactions تتضمن کسبا للإلكترونات، وحيث
أن فقد الإلكترونات من مادة معينة يكون مصحوبا بكسبها من قبل مادة أخرى، لذا فإن تفاعلات
التأكسد والاختزال تتم بشكل مقترن coupled حيث يطلق على
نوعي التفاعلات معا redox reactions ونظرا لأن فقد
إلكترون من مادة معينة في حالة التأكسد لا يتم بسهوله لذا فإن فقده يتم عادة على
هيئة انتقال لذرة هيدروجين كاملة ( تتكون من بروتون والكترون) ولهذا فإن التأكسد
يتم على هيئة نزع لذرة هيدروجين dehydrogenation كما أن الاختزال
يتم على هيئة إضافة ذرة هيدروجين أو هدرجة hydrogenation.
ولو أردنا تمثيل زوج من تفاعلات التأكسد والاختزال بناء
على هذا المفهوم فإن ذلك سيكون بالشكل الآتي:
حيث AH: مادة معطية
للإلكترونات الإلكترونات مرتبطة بالهيدروجين )،
B : مادة مستقبلة للإلكترونات، A
: مادة جرى أكسدتها ( فقدت إلكترونات على هيئة هيدروجين)، BH
: مادة جرى اختزالها ( اكتسبت إلكترونات على هيئة هيدروجين). وحيث أن المركبات
العضوية المختزلة بشكل كبير (أي المحتوية على عدد كبير من ذرات الهيدروجين) تكون
ذات طاقة عالية والمركبات المؤكسدة عادة تكون ذات طاقة أقل، فإن الخلية تحصد بعض
الطاقة بتحويل المركبات العضوية المختزلة إلى مركبات مؤكسدة .
ففي التنفس الخلوي cellular
respiration يجرى تحطيم المركبات العضوية (جلوكوز مثلا C6H1206)
بعملية أكسدة فتنتقل الإلكترونات (على شكل هيدروجين) إلى الأكسجين (مستقبل
للإلكترونات والهيدروجين) مما ينتج مركبات قليلة الطاقة: CO2
والماء، وتتحرر الطاقة كما في المعادلة الآتية :
- حيث أنC6H1206 : مركب عضوي معطي للإلكترونات ذي طاقة عالية، 02 مادة مستقبلة للإلكترونات، CO2 :مادة جرى أكسدتها،H2O :مادة جرى اختزالها
لا يتم انتقال الإلكترونات (والهيدروجين) في هذا
التفاعل مباشرة من جلوكوز إلى أكسجين بل إن ذلك يتم بانتقالها أولا إلى مركبات
مستقبلة للإلكترونات تدعى مرافقات الأنزيمات coenzymes
أشهرها FAD، NAD * لدى انتقال
الإلكترونات (والهيدروجين) إلى هذه المرافقات الأنزيمية فإن الأخيرة تختزل ( تصبح FADH2،
NADH
+ H) لتصبح محملة بالطاقة.
يجري استخراج الطاقة من هذه المركبات لاحقا بأن تنتقل
الإلكترونات عبر مجموعة من المركبات موجودة في الغشاء الداخلي لميتوكوندريا تدعى
سلسلة نقل الإلكترون electron transport chain إلى أن تسلم
الإلكترونات في النهاية إلى الأكسجين الذي يختزل إلى الماء وتتحرر الطاقة لتخزن في
جزيئات ATP. وهذا المحصول من الطاقة هو الذي تستثمره
الخلية في النهاية لتقوم بنشاطاتها المختلفة ، كالنقل النشط، والبناء الحيوي،
والانقباض (شكل 3). يطلق على المركبات الخازنة للطاقة مثل ATP
المركبات الفوسفاتية ذات الطاقة العالية high energy
phosphate compounds .
وهناك مركبات أخرى عديدة في الخلية من هذا النوع (أنظر
مثلا المركبات في شكل
4 ) وكلها قادرة على تحرير الطاقة حيث يصاحب تحطمها نقل
مجموعة فوسفات غير عضوية (Pi) إلى مركبات
أخرى. فمركب ATP مثلا يتحطم حسب المعادلة الآتية ::
أما المركبات الأخرى المبينة في الشكل 4 فإن AG
المعيارية (°ZAG) لها تتراوح بين kcal / mol
- إلى kcal/ mol 13-. يمتاز مركب ATP
بأنه يحتل مكانة وسط بين هذه المركبات أي أن هناك مجموعة من المركبات، مثل PEP
وفوسفات كرياتين، تكون قيمة °G لها أكثر سلبية
من تلك ل ATP وهذه المركبات لديها ألفة أقل لمجموعة
فوسفات ولهذا فإنها تعطيها من أجل تكوين ATP كما في المعادلة
التالية:
كذلك فإن ATP نفسه لديه ألفة لمجموعة فوسفات أقل من جلوكوز - 6 -فوسفات ولهذا فإنه يمكن إنتاج المركب الأخير باستخراج الطاقة من ATP كما في التفاعل الآتي:
يسمى التفاعل الكيميائي الذي يتم بموجبه نقل مجموعة فوسفات لتكوين مركب فوسفاتي ذي طاقة عاليه بالفسفرة على مستوى المادة الحليلة substrate - level phosphorylation أما تكوين مركب فوسفاتي عالي الطاقة باستخدام سلسلة نقل الإلكترون فيدعى فسفرة تأكسدية oxidative phosphorylation . وسوف نرى أن عملية التنفس الخلوي تشمل كلا من نوعي الفسفرة هذين.
الفصل الرابع:
·
دفق الطاقة في النظام الحيوي
الأرضي
·
العوامل المحددة لمعدل
التفاعلات الكيميائية
·
تفاعلات التأكسد والاختزال
في الخلية
المصادر
- التشريح الوظيفي وعلم وظائف الأعضاء ، الدكتور شتيوي العبدالله (2012) ، دار المسيرة عمان – الأردن.
- Prosser, C. Ladd (1991). Comparative Animal Physiology, Environmental and Metabolic Animal Physiology (4th ed.). Hoboken, NJ: Wiley-Liss. pp. 1–12. ISBN 978-0-471-85767-9.
- Hall, John (2011). Guyton and Hall textbook of medical physiology (12th ed.). Philadelphia, Pa.: Saunders/Elsevier. p. 3. ISBN 978-1-4160-4574-8.
- Widmaier, Eric P.; Raff, Hershel; Strang, Kevin T. (2016). Vander's Human Physiology Mechanisms of Body Function. New York, NY: McGraw-Hill Education. pp. 14–15. ISBN 978-1-259-29409-9.
- R. M. Brain. The Pulse of Modernism: Physiological Aesthetics in Fin-de-Siècle Europe. Seattle: University of Washington Press, 2015. 384 pp., [1].
- Rampling, M. W. (2016). "The history of the theory of the circulation of the blood". Clinical Hemorheology and Microcirculation. 64 (4): 541–549. doi:10.3233/CH-168031. ISSN 1875-8622. PMID 27791994. S2CID 3304540.
- Bernard, Claude (1865). An Introduction to the Study of Ex- perimental Medicine. New York: Dover Publications (published 1957).
- Bernard, Claude (1878). Lectures on the Phenomena of Life Common to Animals and Plants. Springfield: Thomas (published 1974).
- Brown Theodore M.; Fee Elizabeth (October 2002). "Walter Bradford Cannon: Pioneer Physiologist of Human Emotions". American Journal of Public Health. 92 (10): 1594–1595. doi:10.2105/ajph.92.10.1594. PMC 1447286.
- Heilbron, J. L. (2003). The Oxford Companion to the History of Modern Science, Oxford University Press, p. 649, link.
- Feder, ME; Bennett, AF; WW, Burggren; Huey, RB (1987). New directions in ecological physiology. New York: Cambridge University Press. ISBN 978-0-521-34938-3.
- Garland, Jr, Theodore; Carter, P. A. (1994). "Evolutionary physiology" (PDF). Annual Review of Physiology. 56 (1): 579–621. doi:10.1146/annurev.ph.56.030194.003051. PMID 8010752.















Comments
Post a Comment